ALPINE3期試驗達到主要終點,結果顯示百悅澤®對比伊布替尼具有更優的研究者評估總緩解率
早期無進展生存期和總生存期數據支持緩解率結果
百悅澤®在關鍵次要終點房顫或房撲事件率方面顯示出優效性,具有總體心臟安全性優勢
公司將於北京時間6月12日(週六)零點(美東時間6月11日中午12點)召開線上投資者會議
美國麻省劍橋和中國北京2021年6月11日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160)是一家全球化的生物科技公司,專注於在世界範圍內開發和商業化創新藥物。公司今日公佈了其BTK抑制劑百悅澤®(澤布替尼)3期研究ALPINE的期中分析結果,結果顯示對比伊布替尼,百悅澤®用於治療患有復發或難治性(R/R)慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)的成年患者時,在研究主要終點,即研究者評估的 總緩解率(ORR),和關鍵次要終點房顫或房撲事件率方面均顯示出了優效性。
這些結果已在2021年歐洲血液學會(EHA2021)第26屆線上大會的主席研討會上以口頭報告的形式發佈,同時入選年會的線上新聞發佈會。此次大會在線上召開,時間為2021年6月9日至17日。
ALPINE試驗的研究者,利茲大學實驗血液學教授Peter Hillmen博士、醫學學士說道:「雖然伊布替尼誕生之初改變了慢性淋巴細胞白血病(CLL)患者的生存前景,但並不是所有患者都能對它產生應答,而且長期使用時產生的毒性問題也仍然有待解決。ALPINE是CLL領域中針對伊布替尼的頭對頭研究,也是目前唯一一項在一款選擇性更強的BTK藥物中,顯示出比伊布替尼療效更佳的研究。相比伊布替尼,百悅澤®在復發或難治性CLL患者中取得了更優的經研究者評估的總緩解率。此外,百悅澤®在房顫或房撲事件率這項重要心臟毒性指標上的數值也顯著低於伊布替尼。」
百濟神州血液學首席醫學官Jane Huang博士表示:「ALPINE試驗期中分析取得了積極結果,百悅澤®顯示出了更優的總緩解率、無進展生存期和總生存期的支持性初步數據、並顯著降低了任何級別的房顫事件發生率。這使我們更加肯定,百悅澤®的差異化特徵可以為CLL患者帶來臨床獲益。而公司開展的ALPINE和ASPEN兩項對比百悅澤®和一代BTK抑制劑伊布替尼的頭對頭試驗也印證了,百悅澤®具備成為同類最優藥物的潛力,能夠為患者帶來有臨床意義的疾病緩解,同時也有良好的、穩定的安全性。除了ALPINE,我們目前也在開展一項3期試驗SEQUOIA研究,評估百悅澤®在初治CLL患者中的有效性和安全性,該研究有望最早於今年晚些時候公佈主要結果。」
在 R/R CLL 患者中對比百悅澤®和伊布替尼的 ALPLINE 試驗的期中分析
口頭報告 :摘要代碼:LB1900
在EHA上公佈的計劃中的期中分析結果均來自於首先入組ALPINE試驗的415例患者,其中207例患者接受百悅澤®治療,208例接受伊布替尼治療。
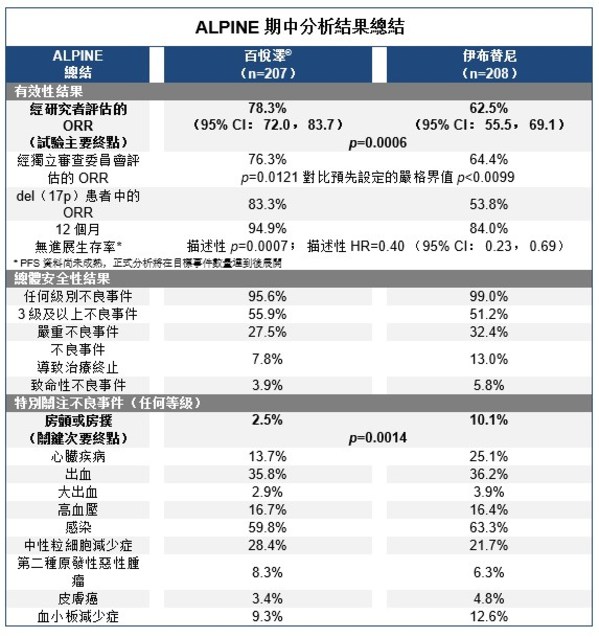
截止期中分析,在中位隨訪時間為15. 3個月時,試驗已達到主要終點,相較伊布替尼,結果顯示百悅澤®經研究者評估的ORR(即,完全緩解[CR]和部分緩解[PR]患者相加比例)具優效性。而經研究者評估,百悅澤®的ORR展示了優效性。在期中分析中,百悅澤®取得了經獨立審查委員會(IRC)分析的ORR非劣性。試驗有效性結果如下:
- 經研究者評估,百悅澤®顯示出78.3%的ORR(95% CI: 72.0, 83.7),對比伊布替尼62.5%(95% CI:55.5,69. 1),達到具有統計意義的改善(p=0.0006)
- 經IRC評估,百悅澤®顯示出76.3%的ORR,相比伊布替尼的64.4%,儘管數值上更高,但不具有統計意義的改善(p=0.0121,對比預先設定的嚴格界值p<0.0099)
- 經研究者評估,在腫瘤組織中染色體17p缺失,即del(17p)的患者中, 百悅澤®組患者獲得了83.3%的ORR,而伊布替尼組數據為53.8%
- PFS資料尚未成熟,正式分析將在目標事件數量達到後開展。 經研究者評估,在12個月時,百悅澤®組的無進展生存率為94.9%,伊布替尼組為84.0%(描述性p=0.0007;描述性風險比[HR]= 0.40 [95% CI: 0.23, 0.69])
- 總生存期(OS)資料尚未成熟。 在12個月時,百悅澤®組的總生存率為97.0%,伊布替尼組數據為92.7%(描述性p=0.1081; 描述性HR=0.54 [95% CI: 0.25, 1.16])
截止期中分析時,ALPINE同樣也達到了預定的有關安全性的關鍵次要終點,結果顯示百悅澤®相比伊布替尼顯著降低了房顫和房撲風險,同時在總體的心臟安全性指標上更有優勢。伊布替尼組更常發生患者治療終止的事件。 試驗安全性結果如下:
- 百悅澤®組有195例患者(95.6%)發生至少1起任何級別的不良事件(AE),而伊布替尼組則有205例患者(99.0%)。 最常見(≥ 10%)的AE包括貧血(百悅澤vs. 伊布替尼:13.2% vs. 15.0%)、關節痛(9.3% vs. 14.0%)、挫傷(10.3% vs. 8.7%)、咳嗽(12.7% vs. 6.3%)、腹瀉(16.7% vs. 19.3%)、高血壓(15.7% vs. 13.0% ),肌肉痙攣(2.9% vs. 11.1%)、中性粒細胞減少症(19.6% vs. 15.5%)、上呼吸道感染(21.6% vs. 14.0%)和尿路感染(10.8% vs. 8.2%)
- 百悅澤®組有114例患者(55.9%)發生了3級及以上AE,伊布替尼組有106 例患者(51.2%)
- 百悅澤®組有56例患者(27.5%)發生了嚴重AE,伊布替尼組有67例患者(32.4%)
- 百悅澤®組分別有23例患者(11.3%)和81例患者(39.7%)因AE降低劑量或中斷給葯;而伊布替尼組分別有25例患者(12.1%)和84例患者(40.6%)因AE降低劑量或中斷給葯
- 16例患者(7.8%)因AE而終止百悅澤®治療,其中無心臟疾病AE發生;相比之下,27例患者(13.0%)因AE終止伊布替尼治療,其中7例由心臟疾病引起,包括2例房顫和心臟停搏、心力衰竭、心肌梗死、心悸和室顫各1例
- 百悅澤®組有8例患者發生致死性AE(3.9%),而伊布替尼組有12例(5.8%)
- 關鍵次要終點任何級別房顫或房撲事件率在百悅澤®組中為2.5%(5例患者),遠低於伊布替尼組的10.1%(21例患者,p=0.0014)
- 百悅澤®組有2例患者(1.0%)發生3級及以上房顫或房撲,而伊布替尼組則有4例患者(1.9%)
- 此外,特別關注的AE方面,兩組數據對比如下:心臟疾病(百悅澤®vs.伊布替尼:13.7% vs. 25.1%)、出血(35.8% vs. 36.2%)、大出血(2.9% vs. 3.9%)、高血壓(16.7% vs. 16.4%)、感染(59.8% vs. 63.3%)、中性粒細胞減少症(28.4% vs. 21.7%)、第二種原發性惡性腫瘤(8.3% vs. 6.3%)、皮膚癌(3.4% vs. 4.8%)和血小板減少症(9.3% vs. 12.6%)
- 特別關注的3級及以上AE,兩組數據對比如下:心臟疾病(百悅澤®vs.伊布替尼:2.5% vs. 6.8%)、出血(2.9% vs. 2.9%)、大出血(2.9% vs. 2.9%)、高血壓(10.8% vs. 10.6%)、感染(12.7% vs. 17.9%)、中性粒細胞減少症(18.6% vs. 15.0% )、第二種原發性惡性腫瘤(4.9% vs. 1.9%)、皮膚癌(1.5% vs. 1.0%)和血小板減少症(3.4% vs. 3.4%)
ALPINE期中分析結果總結
ALPINE |
百悅澤® |
伊布替尼 |
||
有效性結果 |
||||
經研究者評估的 ORR |
78.3% |
62.5% |
||
p=0.0006 |
||||
經獨立審查委員會評估的ORR |
76.3% |
64.4% |
||
p=0.0121 對比預先設定的嚴格界值p<0.0099 |
||||
del(17p)患者中的ORR |
83.3% |
53.8% |
||
12個月 |
94.9% |
84.0% |
||
描述性p=0.0007; 描述性HR=0.40 (95% CI: 0.23, 0.69) |
||||
* PFS 資料尚未成熟,正式分析將在目標事件數量達到後展開 |
||||
總體安全性結果 |
||||
任何級別不良事件 |
95.6% |
99.0% |
||
3級及以上不良事件 |
55.9% |
51.2% |
||
嚴重不良事件 |
27.5% |
32.4% |
||
不良事件 |
7.8% |
13.0% |
||
致命性不良事件 |
3.9% |
5.8% |
||
特別關注不良事件(任何等級) |
||||
房顫或房撲 |
2.5% |
10.1% |
||
p=0.0014 |
||||
心臟疾病 |
13.7% |
25.1% |
||
出血 |
35.8% |
36.2% |
||
大出血 |
2.9% |
3.9% |
||
高血壓 |
16.7% |
16.4% |
||
感染 |
59.8% |
63.3% |
||
中性粒細胞減少症 |
28.4% |
21.7% |
||
第二種原發性惡性腫瘤 |
8.3% |
6.3% |
||
皮膚癌 |
3.4% |
4.8% |
||
血小板減少症 |
9.3% |
12.6% |
||
欲瞭解更多百濟神州的研發和在EHA2021前後的活動,請訪問 https://beigenemedical.eu。
百濟神州EHA2021投資者電話會議和網路直播信息
百濟神州將於北京時間6月12日(週六)零點(北美東部時間6月11日中午12點)舉行投資人及分析師電話會議和網路直播,討論ALPINE臨床試驗在期中分析中獲得的結果、在EHA2021展示的其他數據及百悅澤®的臨床項目。
可通過百濟神州官方網站投資人版塊(http://ir.beigene.com或http://hkexir.beigene.com)收看本次電話會議的在線直播。會議結束兩小時后,可在90天內訪問官網投資人版塊觀看視頻重播。
關於慢性淋巴細胞白血病和小淋巴細胞淋巴瘤
慢性淋巴細胞白血病(CLL)是成年人中最常見的一種白血病,在2017年,全球範圍內約有114000起新增病例1,2。CLL導致患者骨髓中的白細胞及淋巴細胞持續增多,而腫瘤細胞在骨髓中不斷增殖將削弱患者抵抗感染的能力,並能夠進入患者血液,從而浸潤至淋巴結、肝臟、脾臟及身體其它器官1,3。BTK通路是惡性B細胞傳導信號的重要介質,能夠促進CLL發病4。 小淋巴細胞淋巴瘤(SLL)是一種非何杰金氏淋巴瘤,主要影響免疫系統中的B淋巴細胞。SLL與CLL相似,但腫瘤細胞主要蓄積於淋巴結中5。
關於ALPINE臨床試驗
ALPINE是一項隨機全球3期臨床試驗(NCT03734016),旨在評估百悅澤®對比伊布替尼用於治療先前接受過治療的復發或難治性(R/R)慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者。
該試驗中,652例患者被隨機至兩個試驗組接受治療,直至疾病進展或出現不可接受毒性;一個試驗臂中的患者接受劑量為每次160 mg、每日兩次的百悅澤®治療;另一試驗臂中的患者接受劑量為每次420 mg、每日一次的伊布替尼治療。總緩解率(ORR)的主要終點定義為百悅澤®對比伊布替尼達到預先設定的非劣效性。 研究者及獨立審查委員會(IRC)基於國際慢性淋巴細胞白血病工作組(iwCLL)指導原則(2008年修訂版)評估CLL患者的緩解(但針對治療相關淋巴細胞增多CLL患者的評價標準有所調整),以及Lugano非霍奇金淋巴瘤分類標準評估SLL患者的緩解。經研究者和IRC評估的ORR將採用分級測試,首先評估非劣效性,隨後評估優效性。 關鍵次要終點包括無進展生存期(PFS)和房顫或房撲事件率;其他次要終點包括持續緩解時間(DoR)、總生存期(OS)以及不良事件發生率。該項試驗目前正在進行中,將對經IRC評估的ORR優效性預先設定終點進行最終分析,以及在達到目標事件數量後對PFS進行正式分析。結果預期於2022年公佈。
關於百悅澤®(澤布替尼)
百悅澤®(澤布替尼)是一款由百濟神州科學家自主研發的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,目前正在全球進行廣泛的臨床試驗項目,作為單葯和與其他療法進行聯合用藥治療多種 B 細胞惡性腫瘤。由於新的BTK會在人體內不斷合成,百悅澤®的設計通過優化生物利用度、半衰期和選擇性,實現對BTK蛋白完全、持續的抑制。憑藉與其他獲批BTK抑制劑存在差異化的藥代動力學,百悅澤®能在多個疾病相關組織中抑制惡性B細胞增殖。
百悅澤®已在以下地區中獲批如下適應症:
- 2019年11月,百悅澤®在美國獲批用於治療既往接受過至少一項療法的套細胞淋巴瘤(MCL)患者*;
- 2020年6月,百悅澤®在中國獲批用於治療既往至少接受過一種治療的成年套細胞淋巴瘤 (MCL)患者**;
- 2020年6月,百悅澤®在中國獲批用於治療既往至少接受過一種治療的成年慢性淋巴細胞白血病(CLL)/小淋巴細胞淋巴瘤(SLL)患者**;
- 2021年2月,百悅澤®在阿拉伯聯合大公國獲批用於治療復發或難治性MCL患者;
- 2021年3月,百悅澤®在加拿大獲批用於治療華氏巨球蛋白血症(WM)成年患者
目前,除美國和中國以外,共有30多項百悅澤®針對多項適應症的相關上市申請完成遞交工作,覆蓋歐盟以及其他20多個國家。
*該項適應症基於總緩解率(ORR)獲得加速批准。 針對該適應症的完全批准將取決於驗證性試驗中臨床益處的驗證和描述。
**該項適應症獲附條件批准。 針對該適應症的完全批准將取決於正在開展的確證性隨機、對照臨床試驗結果。
關於百濟神州腫瘤學
百濟神州通過自主研發或與志同道合的合作夥伴攜手,不斷推動同類最佳或同類第一的臨床候選藥物研發,致力於為全球患者提供有影響力、可及且可負擔的藥物。 公司全球臨床研究和開發團隊已有約2300人,團隊規模還在不斷擴大。 這支團隊目前正在全球範圍支持開展90多項臨床研究,已招募患者和健康受試者超過13000人。百濟神州自有的臨床開發團隊規劃並主導公司產品管線的研發和擴充,為覆蓋全球40多個國家/地區的臨床試驗提供支持和指導。公司特別關注血液腫瘤和實體腫瘤的靶向治療及腫瘤免疫治療,並重點研究單葯和聯合療法。目前,百濟神州自主研發的三款藥物已獲批上市:百悅澤®(BTK 抑制劑,已在美國、中國、加拿大及其他國際市場獲批上市)、百澤安®(可有效避免 Fcγ 受體結合的抗 PD-1 抗體,已在中國獲批上市)以百匯澤®(PARP 抑制劑,已在中國獲批上市)。
同時,百濟神州還與其他創新公司合作,共同攜手推進創新療法的研發,以滿足全球健康需求。 在中國,百濟神州正在銷售多款由安進和百時美施貴寶授權的腫瘤藥物。公司也通過與包括安進、百奧泰、EUSA Pharma、Mirati Therapeutics、Seagen以及Zymeworks在內的多家公司合作更大程度滿足當前全球範圍尚未被滿足的醫療需求。百濟神州還與諾華公司達成合作,授權諾華在北美、歐洲和日本開發、生產和商業化百澤安®。
關於百濟神州
百濟神州是一家立足科學的全球生物科技公司,專注於開發創新、可負擔的藥物,以為全球患者改善治療效果和提高藥物可及性。公司廣泛的藥物組合目前包括40多款臨床候選藥物,通過強化公司自主競爭力以及與其他公司開展合作,我們致力於加速現有多元、創新藥物管線的開發進程,希望能在2030年之前為全球20多億人全面改善藥物可及性。百濟神州在全球五大洲打造了一支近6000人的團隊。欲瞭解更多信息,請訪問 www.beigene.com.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律下定義的前瞻性聲明,包括關於ALPINE3期臨床試驗期中分析結果,百悅澤®與其他BTK抑制劑相比的潛在臨床獲益和優勢,ALPINE臨床試驗最終分析和SEQUOIA3期臨床試驗主要結果的預期時程表,百濟神州對百悅澤®的推進計劃、預期的臨床開發、藥政里程碑和商業化進程,在「百濟神州腫瘤學」和「關於百濟神州」副標題下提及的百濟神州計劃、承諾、抱負和目標。 這些因素包括了以下事項的風險:ALPINE3期臨床試驗期中分析初步結果與最終分析可能不一致;ALPINE臨床試驗期中分析或最終分析結果可能無法支持百悅澤®用於治療CLL患者的相關藥物上市申請,以及此類上市申請和潛在獲批的時間表;臨床數據繼續支持百悅澤®的效益風險特徵;百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現並保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營以及其他業務帶來的影響;以及百濟神州在最近季度報告的10-Q表格中「風險因素」章節裡更全面討論的各類風險;以及百濟神州向美國證券交易委員會期後呈報中關於潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及於新聞稿發佈之日,除非法律要求,百濟神州並無責任更新該些信息。
- American Cancer Society. Cancer Facts & Figures 2021. Atlanta; American Cancer Society; 2021. Available here: Cancer Facts and Figures 2021
- Global Burden of Disease Cancer Collaboration. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017. JAMA Oncol. 2019;5(12):1749-1768.
- National Cancer Institute. Chronic Lymphocytic Leukemia Treatment (PDQ®)–Patient Version. Available here: Chronic Lymphocytic Leukemia Treatment (PDQ®)–Patient Version
- Haselager MV et al. Proliferative Signals in Chronic Lymphocytic Leukemia; What Are We Missing? Front Oncol. 2020; 10: 592205.
- Cancer Support Community. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Available here: https://www.cancersupportcommunity.org/chronic-lymphocytic-leukemiasmall-lymphocytic-lymphoma.
- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt