美國羅克維爾和中國蘇州2024年1月2日 /美通社/ -- 信達生物製藥集團(香港聯交所股票代碼:01801),一家致力於研發、生產和銷售用於治療腫瘤、自免、代謝、眼科等重大疾病領域創新藥物的生物製藥公司,宣佈:創新胰高血糖素樣肽-1受體(GLP-1R)/胰高血糖素受體(GCGR)雙重激動劑瑪仕度肽9mg (研發代號:IBI362) 在中國肥胖受試者中的一項III期臨床研究(GLORY-2)完成首例受試者給藥。這也是瑪仕度肽開展的第四項大規模III期臨床研究。
本研究計劃入組約450例受試者,隨機接受瑪仕度肽 9 mg或安慰劑治療。研究的主要終點是第60周時受試者體重相對基線的百分比變化以及體重相對基線下降≥5%的受試者比例。
此前,在一項BMI≥30 kg/m2的中國肥胖受試者中開展的II期研究(NCT04904913)中顯示,在給藥48周後,瑪仕度肽9 mg組體重降幅相較安慰劑組的差值達−18.6%;瑪仕度肽還顯著降低受試者腰圍、血脂、血壓、血尿酸、轉氨酶和肝臟脂肪含量等;耐受性和安全性良好,安全性特徵與其他GLP-1受體激動劑類藥物相似。
本項研究的主要研究者、北京大學人民醫院紀立農教授表示:「在相似的BMI水平下,中國居民體脂率、心血管危險因素患病率和全因死亡率均高於西方人群,因此中國成人超重和肥胖定義中採用了更低的BMI臨界值 (超重BMI切線24 kg/m2, 肥胖BMI切線28 kg/m2)。符合西方肥胖標準的肥胖人群(BMI超過30 kg/m2)往往承受更大的心血管代謝疾病負擔,是臨床上體重管理和代謝綜合征防治需要特別關注的患者群體。這部分患病人群的數量巨大,且呈持續增加趨勢,但目前缺乏有效的藥物治療方案[i]。瑪仕度肽9 mg在更高肥胖基線人群中的 II期研究[ii]中展現出強大的減重療效及多重心血管代謝改善,且安全性良好,有望成為國內首個針對更高基數肥胖人群的減重藥物。我將與GLORY-2的研究者們一起同心協力推進和高質量完成此項研究,在獲得高質量的減重研究臨床證據的同時,為中國中重度肥胖人群提供更優的治療選擇。」
信達生物製藥集團臨床開發副總裁錢鐳博士表示:「我們開發瑪仕度肽不同劑量和給藥方案,為不同程度的肥胖患者群體提供更理想的治療選擇。瑪仕度肽9 mg的開發針對中國BMI在30 kg/m2以上的中重度肥胖患者的減重需求,在該患者群體的II期研究中,瑪仕度肽9 mg治療48周取得了相較安慰劑18.6%的體重降幅,且安全性好,多項心血管代謝獲益,滴定步驟簡潔。我期待瑪仕度肽9 mg在GLORY-2研究中充分展現其強大的療效和良好的安全性,盡快為中重度肥胖患者帶來相比減重手術更理想的藥物治療選擇和安全有效的長期體重管理方案。」
關於肥胖
我國是全球超重和肥胖人口最多的國家,且呈現逐漸上升趨勢[iii]。
肥胖可以導致一系列併發症或者相關疾病,進而影響預期壽命或者導致生活質量下降。在較為嚴重的肥胖患者中,心血管疾病、糖尿病和某些腫瘤的發生率及死亡率明顯上升。2019年超重和肥胖導致的死亡在慢性非傳染性疾病相關死亡中占比11.1%,相比1990年的5.7%顯著增加[iv]。
肥胖症是需要長期治療的慢性疾病,目前缺乏長期有效且安全的治療手段。生活方式干預是超重或肥胖者的首選和基礎治療手段,但是仍有相當一部分患者由於種種原因不能達到期望的減重目標,需用藥物輔助減重。傳統減肥藥減重效果有限,且存在安全性問題,對療效更好且安全的減肥療法的需求尚未得到滿足。
關於瑪仕度肽(IBI362)
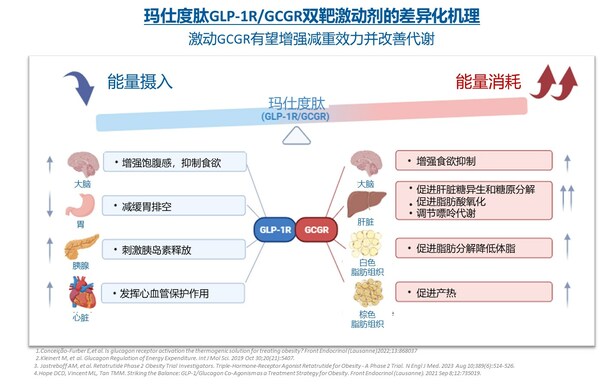
瑪仕度肽(IBI362)是信達生物與禮來製藥共同推進的一款胰高血糖素樣肽-1受體(GLP-1R)/胰高血糖素受體(GCGR)雙重激動劑。作為一種哺乳動物胃泌酸調節素(OXM)類似物,瑪仕度肽除了通過激動GLP-1R促進胰島素分泌、降低血糖和減輕體重外,還可通過激動GCGR增加能量消耗增強減重療效,同時改善肝臟脂肪代謝。瑪仕度肽已在多項臨床研究中展現出優秀的減重和降糖療效,以及降低腰圍、血脂、血壓、血尿酸、肝酶及肝臟脂肪含量,以及改善胰島素敏感性,帶來多重代謝獲益。目前,瑪仕度肽共有四項III期註冊研究進行中,包括GLORY-1(4 mg和6 mg瑪仕度肽治療中國超重或肥胖受試者)、GLORY-2(9 mg瑪仕度肽治療中國肥胖受試者)、DREAMS-1和DREAMS-2(4 mg和6 mg瑪仕度肽治療2型糖尿病受試者)。
關於信達生物
「始於信,達於行」,開發出老百姓用得起的高質量生物藥,是信達生物的使命和目標。信達生物成立於2011年,致力於研發、生產和銷售腫瘤、自身免疫、代謝、眼科等重大疾病領域的創新藥物,讓我們的工作惠及更多的生命。公司已有10個產品獲得批准上市,它們分別是信迪利單抗注射液(達伯舒®),貝伐珠單抗注射液(達攸同®),阿達木單抗注射液(蘇立信®),利妥昔單抗注射液(達伯華®),佩米替尼片(達伯坦®),奧雷巴替尼片(耐立克®), 雷莫西尤單抗注射液(希冉擇®),塞普替尼膠囊(睿妥®),伊基奧侖賽注射液(福可蘇®)和托萊西單抗注射液(信必樂®)。目前,同時還有2個品種在NMPA審評中,5個新藥分子進入III期或關鍵性臨床研究,另外還有19個新藥品種已進入臨床研究。
公司已與禮來、羅氏、賽諾菲、Adimab、Incyte和MD Anderson 癌症中心等國際合作方達成30項戰略合作。信達生物在不斷自研創新藥物、謀求自身發展的同時,秉承經濟建設以人民為中心的發展思想。多年來,始終心懷科學善念,堅守「以患者為中心」,心繫患者並關注患者家庭,積極履行社會責任。公司陸續發起、參與了多項藥品公益援助項目,讓越來越多的患者能夠得益於生命科學的進步,買得到、用得起高質量的生物藥。至2023年10月,信達生物患者援助項目已惠及17余萬普通患者,藥物捐贈總價值34億元人民幣。信達生物希望和大家一起努力,提高中國生物製藥產業的發展水平,以滿足百姓用藥可及性和人民對生命健康美好願望的追求。
詳情請訪問公司網站:www.innoventbio.com 或公司領英賬號www.linkedin.com/company/innovent-biologics/。
聲明:信達不推薦任何未獲批的藥品/適應症使用。
前瞻性聲明
本新聞稿所發佈的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用「預期」、「相信」、「預測」、「期望」、「打算」及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司並無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基於本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述並非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制範圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
[i] Body-mass index and obesity in urban and rural China: findings from consecutive nationally representative surveys during 2004–18 |
[ii] https://www.innoventbio.com/InvestorsAndMedia/PressReleaseDetail?key=407 |
[iii] Pan XF, Wang L, Pan A. Epidemiology and determinants of obesity in China. Lancet Diabetes Endocrinol 2021; 9: 373–92. |
[iv] Institute for Health Metrics and Evaluation. Global Health Data Exchange. GBD results tool. http://ghdx.healthdata.org/gbd-resultstool (accessed Jan 10, 2021). |
相關股票: HongKong:1801 OTC:IVBIY
精選視頻

最近新聞稿
- 銀屑病生物制劑轉換新方案:信達生物匹康奇拜單抗(IL-23p19單抗)在IL-17單抗應答不佳人群的III期臨床研究完成首例受試者給藥
- 榮耀登頂 | 全球首款申報上市的GCG/GLP-1雙受體激動減重降糖藥物瑪仕度肽的臨床研究結果在《新英格蘭醫學雜誌》發布
- 致力於可持續發展,信達生物發布2024年度ESG報告
- 信達生物瑪仕度肽第二項頭對頭司美格魯肽臨床研究:在中國超重或肥胖合併脂肪肝受試者中的III期臨床研究GLORY-3完成首例受試者給藥
- 雙靶頭對頭:信達生物全球首創抗VEGF-補體雙靶融合蛋白依莫芙普(IBI302)治療糖尿病黃斑水腫的II期臨床研究完成首例受試者給藥
- 信達生物全球首創抗VEGF-補體雙靶融合蛋白
- 前往企業新聞室
- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt