|
——頂線數據支持進入3期試驗,且顯示GV1001有望成為全球首款PSP治療藥物
韓國首爾2024年10月30日 /美通社/ -- 當地時間10月24日下午4點45分,GemVax & KAEL Co., Ltd.(簡稱「GemVax」;KOSDAQ股票代碼:082270)在加拿大多倫多舉辦的「Neuro2024:PSP和CBD國際研究研討會」上公佈了其治療進行性核上性麻痺(PSP)的研究用多肽藥物GV1001的2a期臨床試驗(簡稱「2a期PSP臨床試驗」)的頂線結果。
PSP是一種退行性疾病,與帕金森病一樣,也會導致步態障礙、早期跌倒、垂直性凝視麻痺、僵直、震顫和認知能力下降等症狀,但其病程進展更快,目前尚無根治手段。PSP分為多種類型,包括PSP-理查森綜合征(PSP-RS)和PSP-帕金森綜合征(PSP-P)。相較於其他類型,PSP-RS型表現出更為顯著的tau蛋白聚集,且影響範圍更廣,涉及小腦、齒狀核、橋腦核、額葉及頂葉等區域。
2a期PSP臨床試驗是一項為期24周的隨機、雙盲、安慰劑對照前瞻性探索性臨床試驗,在韓國5個研究中心共招募了78名PSP患者。參與者按1:1:1的比例隨機分配,分別接受安慰劑、0.56毫克GV1001或1.12毫克GV1001治療。治療方案為前4周(1個月)每週一次皮下注射,隨後每2周注射一次,持續20周(5個月),總共為期24周(6個月)。該試驗面向PSP-RS和PSP-P兩種類型的患者開放。試驗結果顯示,低劑量組(0.56毫克)療效更為顯著,尤其對PSP-RS型患者效果更佳。
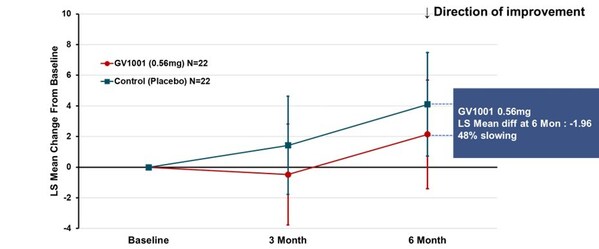
試驗的主要終點是使用GV1001治療24周後PSP評份量表總分(採用MMRM法計算的最小二乘均數)較基線的變化。結果顯示,0.56毫克劑量組病情惡化2.14分,而安慰劑組4.10分,說明疾病進程減緩了48%(見圖1)。儘管未達統計學顯著差異,但這些發現仍揭示了GV1001治療目前無法治癒的PSP的潛力,並為推進GV1001至更高級別臨床試驗提供了依據。
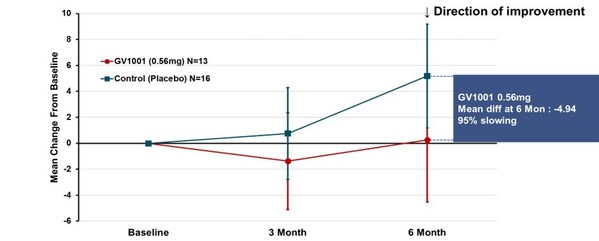
臨床上,多數PSP患者屬於典型的PSP-RS型,這一類型較其他PSP類型病程進展更快,平均生存期也更短。試驗專門針對PSP-RS型患者進行了分組分析。在服用GV1001二十四周後,採用簡單平均法計算PSP評份量表總分均值的變化,結果顯示,0.56毫克劑量組病情惡化平均分為0.25分,而安慰劑組為5.19分,兩組相差4.94分,說明疾病惡化程度降低了95%(見圖2)。
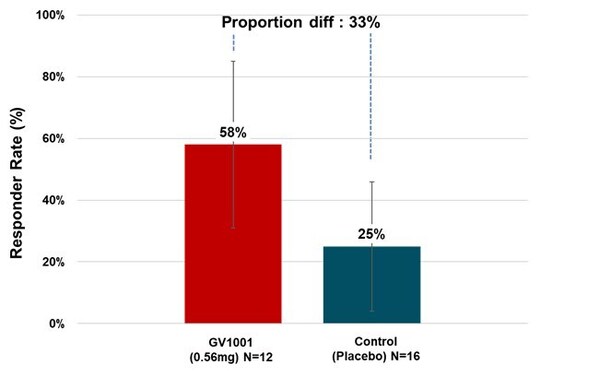
治療組中多數PSP-RS型患者在試驗期間症狀保持穩定甚至有所改善。以治療6個月後PSP評份量表總分與基線相比有所改善或保持穩定的患者比例來計算緩解率,0.56毫克GV1001組有58.33%的PSP-RS型患者症狀得到了改善或穩定(見圖3)。
在2a期PSP臨床試驗中,GV1001的安全性表現與之前的數據相符,整體耐受性良好,未觀察到與藥物相關的嚴重不良事件。
GemVax首席戰略官Hyungsik Moon指出:「本次2a期試驗屬於探索性研究,旨在確定最優劑量及多肽對不同分組的效果。儘管頂線結果未達到統計學顯著性,但所提供的證據已充分支持我們考慮推進至關鍵性試驗,同時表明GV1001有望成為全球首個PSP治療方案。」
出席Neuro2024會議的專家對PSP試驗結果表示歡迎,認為成果振奮人心,並對該藥即將邁入全球3期臨床試驗進行更深入的研發感到高興。
全球CRO ICON藥物開發高級副總裁、醫學博士Peter Schüler表示:「這項試驗性研究並非完全有效,且6個月的治療週期相對較短,因此無法預期獲得具有統計學意義的確證結果。不過,在運動表現和認知功能這兩個領域,我們觀察到的趨勢既合理又一致,均顯示出低劑量組的優勢。」
Schüler博士表示:「本次試驗確定了最佳劑量,這也是2a期研究的主要目標之一,並展現了與安慰劑組相比,病情完全穩定這一具有臨床意義的好處。這些頂線數據為推進至3期研究提供了有力的依據。」
慕尼黑大學附屬醫院(LMU Hospital)神經科主任、全球知名PSP專家Günter U. Höglinger博士評價道:「在全新作用機制的新藥研究中,我們獲得了極為振奮的2期臨床數據。儘管數據尚屬初步,但前景廣闊,且與[GV1001]在阿爾茨海默病中的臨床數據相契合。我對接下來的研發充滿期待,並很榮幸能參與並領導[PSP]的3期研究。」
CurePSP主任Kristophe Diaz博士表示:「GemVax最近的臨床試驗結果令人振奮,為整個PSP群體,包括目前尚無治療選擇的患者、家屬及治療他們的醫生,帶來了希望。我們祝賀GemVax成功完成試驗,並期待其能繼續為PSP社群帶來更多福祉。」他還強調:「CurePSP將一如既往地致力於合作,支持為這一毀滅性疾病患者帶來希望與成果的各項工作。」
下載PDF:https://mma.prnewswire.com/media/2542940/2024_10_29__GemVax_Announces_Topline_Results.pdf
關於2a期PSP臨床試驗(NCT05819658)
2a期PSP臨床試驗是一項為期24周的多中心、隨機、雙盲、安慰劑對照前瞻性探索性臨床研究,旨在評估0.56毫克或1.12毫克GV1001與安慰劑相比在治療PSP患者上的安全性和療效。主要終點為使用GV1001治療24周後,PSP評份量表總分相對於基線的變化。次要終點則包括3個月時PSP評份量表總分以及3個月和6個月時MoCA-K、K-FAB和ES-ADL評分相對於基線的變化。此外,研究還全面評估了GV1001的總體安全性。
關於GV1001
GV1001是一種合成肽,由16個氨基酸構成,以端粒酶的關鍵序列為基礎。它已被研究用於治療包括阿爾茨海默病和PSP在內的神經退行性疾病。研究顯示,GV1001能夠調節神經膠質細胞的表型並減輕神經炎症。除了正在進行的2a期PSP臨床試驗外,針對阿爾茨海默病的2期臨床試驗也正在美國和歐洲同步推進(NCT05189210)。
關於PSP
進行性核上性麻痺是一種罕見的、成年後發病的進行性神經退行性疾病,目前尚無藥物能改變其病程。全球發病率約為每十萬人中有七例,且男性更為常見。患者多為60歲以上的老年人。PSP的症狀包括平衡感喪失、性格變化、眼球活動無力(尤其是向下看時)、吞嚥困難、言語不清以及認知功能受損。
關於GemVax & KAEL
GemVax & KAEL Co., Ltd.是韓國一家處於臨床階段的生物製藥先鋒企業,專注於研發治療神經退行性疾病(如進行性核上性麻痺和阿爾茨海默病)的專利療法。針對PSP,GemVax正在韓國進行2a期研究,以評估GV1001對PSP患者的療效與安全性,同時也在籌備全球性的PSP臨床試驗。此外,公司目前還在美國和歐洲同步開展阿爾茨海默病的2期臨床試驗。欲瞭解更多信息,請訪問www.gemvax.com並在Linkedin上關注我們。
前瞻性陳述
本文件所含信息包括或基於《1995年證券訴訟改革法案》界定的「前瞻性陳述」。這些陳述可能使用「計劃」、「將要」、「預計」、「預測」、「打算」、「相信」、「潛力」、「繼續」等明確標識詞,或其他類似表述,也可能不使用。此類陳述受已知和未知風險及不確定性的影響,可能導致實際結果與陳述中明示或暗示的結果有重大出入。這些風險和不確定性包括但不限於:藥物研發的固有挑戰(如臨床前和臨床項目的時間安排和結果,這些項目因高風險而可能在任何階段失敗,包括監管審批前後因療效不佳、安全性問題或其他因素導致的失敗);我們利用和加強藥物發現平台的能力;我們為開發活動和其他企業目的籌集資金的能力;我們合作項目的成敗;我們獲得監管批准並最終實現藥物候選產品商業化的能力;我們獲取、維持和落實知識產權保護的能力;我們的技術系統遭受網絡攻擊或其他干擾的風險;我們吸引、激勵和留住關鍵人才以及管理增長的能力;通貨膨脹和其他宏觀經濟問題;以及其他風險和不確定性。所有前瞻性陳述均基於管理層當前的估計、預測和假設,除非法律另有要求,GemVax不承擔更正或更新這些陳述的義務,無論是因為新信息的出現、未來事態的發展還是其他原因。
相關股票: Korea:082270
精選視頻

最近新聞稿
- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt