江蘇蘇州2019年6月18日 /美通社/ -- 信達生物製藥(香港聯交所股票代碼:01801),是一家致力於研發、生產和銷售用於治療腫瘤、自身免疫疾病等重大疾病的創新藥物的生物製藥公司。今天宣佈:信達生物製藥與南京馴鹿醫療技術有限公司聯合開發的全人源BCMA CAR-T細胞(研發代號:CT103A),在剛結束的第24屆歐洲血液學協會年會 (EHA) 和第55屆美國臨床腫瘤學會年會 (ASCO)上,分別以口頭報告和壁報展示的形式對外公佈一項由研究者發起、在華中科技大學同濟醫學院附屬同濟醫院開展的臨床試驗研究數據(壁報摘要# 8013,美國中部時間6月4日;口頭髮言摘要#S827,中歐夏令時間 6月15日(週六)下午12:35 PM - 12:45 PM)。
CT103A是信達生物與馴鹿醫療聯合開發的抗BCMA CAR-T細胞注射液,擬用於治療復發或難治性多發性骨髓瘤。在ASCO和EHA年會上,CT103A展示了積極的數據:客觀緩解率 (ORR) 為100%,並且CAR-T在體內具有很強的持久性和擴增能力,將有望為復發/難治性多發性骨髓瘤 (RRMM) 患者提供一個全新的治療手段,特別是對曾接受鼠源單鏈抗體CAR-T治療復發的患者也表現出良好的治療效果。
多發性骨髓瘤 (multiple myeloma, MM) 是一種克隆性漿細胞異常增殖的惡性血液系統腫瘤,迄今在醫學上尚無法治癒。在很多國家,多發性骨髓瘤是第二常見的血液腫瘤。據美國癌症協會估計,2019年美國將會有32,110例新增確診案例。2018年歐洲有超過48,200位患者被診斷出多發性骨髓瘤,其中的40%為中高危多發性骨髓瘤患者,其中位存活時間不超過5年。
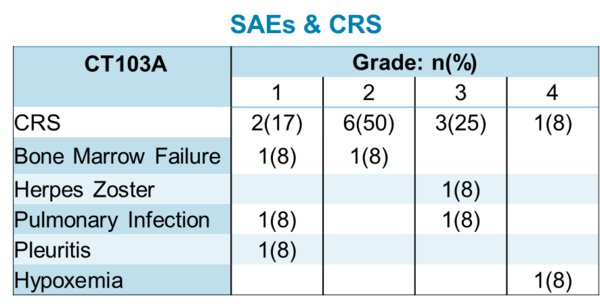
截至2019年5月22日,在11名接受CT103A治療的可評估受試者中,客觀緩解率 (ORR) 達100%(7例CR、4例VGPR),最長隨訪時間8個月。CAR-T在患者體內表現出很好的擴增能力和持久性。所有的患者均接受了CRS評估,CRS在2-5天內發生(中位數:2.6天),並在14天內消退。中低劑量組大部分CRS為一到二級,高劑量組觀察到更高級別的CRS,CRS常規使用托珠單抗和類固醇治療。值得關注的是,11例可評估患者中包括4例先前接受過鼠源抗BCMA CAR-T治療後復發的患者,其中3例完全緩解 (CR) ,1例非常好的部分緩解 (VGPR) 。

圖1:臨床數據 -- 臨床數據圖顯示客觀緩解率(ORR) 100%,完全緩解(CR) 64%,非常好的部分緩解(VGPR) 36%。加粗和下劃線表明患者先前接受過CAR-T治療後復發。(數據截至: 05/22/2019)
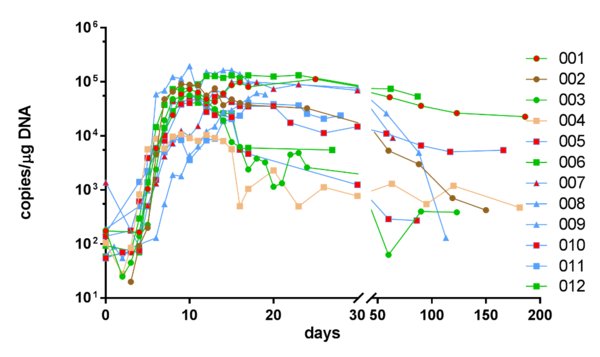
圖2:CT103A擴增和持久性 -- CAR-T回輸後的擴增和持久性。線的顏色表示患者14天的療效評價; 劑量為1(圓形)、3(正方形)、6(三角形)x106細胞/公斤;紅色填充符號表示患者在先前CAR-T治療中失敗。(數據截至: 05/22/2019)
「復發/難治性多發性骨髓瘤 (RRMM) 與預後不良有關,」華中科技大學同濟醫學院附屬同濟醫院李春蕊主任表示。「許多接受鼠源單鏈抗體 (scFv) CAR-T治療的患者已經出現復發,由於免疫原性無法進行再治療。CT103A具有全人源BCMA scFv,不僅首次治療具有突出療效,而且也為這些復發患者提供了一個有效的解決方案。這些數據表明,未來臨床試驗時不應排除該部分受試者。」
關於復發/難治性多發性骨髓瘤
對於初治的多發性骨髓瘤患者,常用的一線治療藥物包括蛋白酶體抑制劑、免疫調節類藥物及烷化劑類藥物。對於大多數的患者,常用的一線治療可以使患者的病情穩定3-5年,但也有少部分患者在初治時表現為原發耐藥,病情不能得到有效控制。復發患者為:經治療疾病達到完全緩解後,疾病再次出現的患者。難治的患者表現為:原發耐藥患者;經過標準的一線治療後,疾病不能達到緩解或達到微小緩解後60天內出現疾病進展的患者。對於治療有效的大多數初治患者,在經過3-5年的疾病穩定期後也將不可避免的進入復發、難治階段,對於這部分患者現有的二線治療總體有效率大概在40至70%,且緩解時間短。
關於 CT103A
CT103A是由信達生物製藥和馴鹿醫療聯合開發的一種全人源BCMA CAR-T創新產品。既往研究表明,接受高劑量BCMA靶向CAR-T細胞治療的復發/難治性多發性骨髓瘤 (RRMM) 患者可能獲得更好的緩解,但不良事件更嚴重。此外,一旦病情再次惡化,CAR-T細胞的再回輸是無效的。CT103A的開發有望解決這一難題。它以慢病毒為基因載體轉染自體T細胞,CAR包含全人源scFv、CD8a 鉸鏈和跨膜、4-1BB共刺激和CD3z激活結構域。基於嚴格的篩選,通過全面的體內外功能評價,CT103A具有良好的臨床應用前景,並有突出的持久性。
關於馴鹿醫療
馴鹿醫療是一家處於臨床階段,致力於癌症創新療法的生物技術公司,成立於2017年3月,由知名臨床專家、科學家與資深投資人聯合創立,致力於通過不斷的臨床研究,開發出真正解決臨床問題的創新細胞類藥物。目前公司擁有十餘個涵蓋血液腫瘤和實體瘤適應症的產品管線。通過與國外優秀抗體平台的合作及自主擁有的全人源抗體庫的篩選,公司所有細胞類藥物均採用下一代全人源抗體。目前已有三個CAR-T細胞產品進入臨床階段。詳情請訪問公司網站:www.iasobio.com。
關於信達生物
「始於信,達於行」,開發出老百姓用得起的高質量生物藥,是信達生物的理想和目標。信達生物成立於2011年,致力於開發、生產和銷售用於治療腫瘤等重大疾病的創新藥物。2018年10月31日,信達生物製藥在香港聯合交易所有限公司主板上市,股票代碼:01801。
目前,公司已建成貫通生物創新藥開發全週期的高質量技術平台,包括研發、藥學開發及產業化、臨床研究和營銷等平台,已建立起了一條包括20個在研新藥品種的產品鏈,覆蓋腫瘤、眼底病、自身免疫疾病、代謝疾病等四大疾病領域,14個品種進入臨床試驗,其中4個品種在臨床III期研究,2個單抗產品的上市申請被國家藥監局受理並被納入優先審評,1個產品(信迪利單抗注射液,商品名:達伯舒R)獲得國家藥品監督管理局批准上市,獲批的第一個適應症是復發/難治性經典型霍奇金淋巴瘤。
信達生物已組建了一支具有國際先進水平的高端生物藥開發、產業化人才團隊,包括眾多海歸專家,並與美國禮來製藥、Adimab、Incyte和韓國Hanmi等國際製藥公司達成戰略合作。信達生物希望和大家一起努力,提高中國生物製藥產業的發展水平,以滿足百姓用藥可及性和人民對生命健康美好願望的追求。詳情請訪問公司網站:www.innoventbio.com。
圖片 - https://photos.prnasia.com/prnh/20190617/2499313-1-a
圖片 - https://photos.prnasia.com/prnh/20190617/2499313-1-b
圖片 - https://photos.prnasia.com/prnh/20190617/2499313-1-c
相關股票: HongKong:1801 OTC:IVBIY
精選視頻

最近新聞稿
- 銀屑病生物制劑轉換新方案:信達生物匹康奇拜單抗(IL-23p19單抗)在IL-17單抗應答不佳人群的III期臨床研究完成首例受試者給藥
- 榮耀登頂 | 全球首款申報上市的GCG/GLP-1雙受體激動減重降糖藥物瑪仕度肽的臨床研究結果在《新英格蘭醫學雜誌》發布
- 致力於可持續發展,信達生物發布2024年度ESG報告
- 信達生物瑪仕度肽第二項頭對頭司美格魯肽臨床研究:在中國超重或肥胖合併脂肪肝受試者中的III期臨床研究GLORY-3完成首例受試者給藥
- 雙靶頭對頭:信達生物全球首創抗VEGF-補體雙靶融合蛋白依莫芙普(IBI302)治療糖尿病黃斑水腫的II期臨床研究完成首例受試者給藥
- 信達生物全球首創抗VEGF-補體雙靶融合蛋白
- 前往企業新聞室
- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt