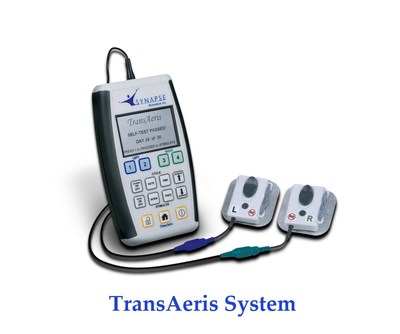
俄亥俄州歐柏林2020年4月15日 /美通社/ -- Synapse Biomedical, Inc. (www.synapsebiomedical.com)的TransAeris®膈肌起搏系統(DPS)已獲得美國食品藥品監督管理局(FDA)的緊急使用授權。在當前新冠肺炎疫情期間,某些患者脫離呼吸機後,醫療機構的醫生認定存在較高的撤機失敗風險。Synapse Biomedical的這款系統獲准用於輔助撤機,授權有效期不超過30天。
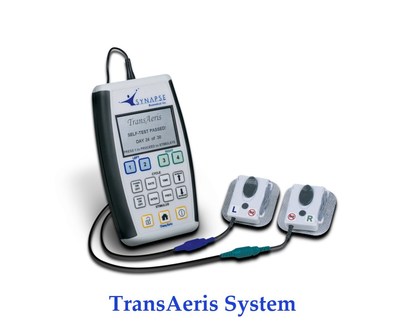
TransAeris系統通過調節患者的膈肌來緩解或避免呼吸機引發的膈肌功能障礙,從而有效解決了這一問題。這項技術近日已獲得CE標誌,目前正在美國進行臨床研究。模型表明,該系統可以將新冠肺炎患者使用呼吸機的時間縮短26%,從而在需求巨大的特殊時期,騰出更多呼吸機。
詳見www.synapsebiomedical.com/covid-19
疫情期間,需要延長機械通氣(PMV)的患者數量激增,對醫院和重症監護病床資源的需求也空前增加。即使患者的病情已基本穩定,這些機械通氣時間延長的患者仍有可能出現呼吸機引發的膈肌功能障礙(VIDD),進一步延長了機械通氣時間。
TransAeris系統通過調節患者的膈肌來緩解或避免上述膈肌功能障礙的出現,從而有效解決了這一問題。這項技術近日已獲得CE標誌,目前正在美國進行臨床研究。模型表明,該系統可以將新冠肺炎患者使用呼吸機的時間縮短26%,從而在需求巨大的特殊時期,騰出更多呼吸機。
Synapse Biomedical總裁兼CEO Anthony Ignagni表示:「我們的膈肌起搏技術已在全球成功治療了2,000多名患者。非常感謝FDA的領導能向我們最新的TransAeris儀器簽發緊急使用授權,這樣一來,臨床醫生就可以在疫情期間為盡可能多的患者提供幫助。」
University Hospitals Cleveland Medical Center(克利夫蘭大學醫院系統醫療中心)普外科主任兼凱斯西儲大學醫學院(Case Western Reserve University School of Medicine)教授Raymond P. Onders(醫學博士、美國外科醫師協會會員(FACS))說道:「創傷以及高危外科和心臟病患者需要重症監護病床和呼吸機,而新冠肺炎患者同樣也需要。在這種情況下,高危手術和新冠肺炎患者使用TransAeris後,有可能或正在延長機械通氣的患者可以減少使用呼吸機的時間,有效緩解了呼吸機、重症監護病床和臨床資源的供應壓力。」
在TransAeris問世之前,Synapse Biomedical的另一項技術,即NeuRx®膈肌起搏系統(NeuRx DPS),自2008年以來已獲得FDA認證和CE標誌,成功幫助脊髓損傷(SCI)患者減少或擺脫了對機械通氣的依賴。TransAeris
可以為機械通氣時間延長的患者提供最長30天的臨時輔助治療。此外,TransAeris簡化了NeuRx DPS系統的外部設計,打造成適合患者使用的一次性器械,時間不超過30天。截止目前,歐洲的一些醫療中心,包括德國的BGU Murnau,已成功將TransAeris應用到急性脊髓損傷和多發傷患者的治療中。
Synapse Biomedical, Inc.簡介:2002年,凱斯西儲大學和University Hospitals of Cleveland(克利夫蘭大學醫院系統)共同組建了Synapse Biomedical。這家公司的使命是通過神經刺激平臺商業化來提供有助改變人生的療法、在科學及臨床發現的基礎上創建可持續發展的企業,從而為患者、員工、社區和股東創造有意義的價值。Synapse總部位於俄亥俄州歐柏林,駐歐洲辦事處位於法國的昂吉安萊班。有關更多信息,請瀏覽www.synapsebiomedical.com。
TransAeris®膈肌起搏系統(DPS)尚未被批准在新冠肺炎疫情期間用於輔助醫療機構的患者脫離呼吸機。該系統目前獲得FDA簽發的緊急使用授權。根據《聯邦食品、藥品和化妝品法》第564條(b)(1)款(21 U.S.C. § 360bbb-3(b)(1))規定,TransAeris DPS僅獲准在國家處於緊急狀態期間使用,不排除授權被提前終止或撤銷的可能。
圖片 - https://mma.prnewswire.com/media/1155320/Synapse_Biomedical_Transaeris_System.jpg
精選視頻

- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt