 |
加州歐文2021年3月11日 /美通社/ -- Zymo Research 今天宣佈,美國食品藥品監督管理局 (FDA) 已核准其 DNA/RNA Shield™ 收集管 成為第二類醫療裝置。FDA 的 510(k) 核准讓該產品可用作 2019 冠狀病毒病測試的體外診斷 (IVD) 裝置。
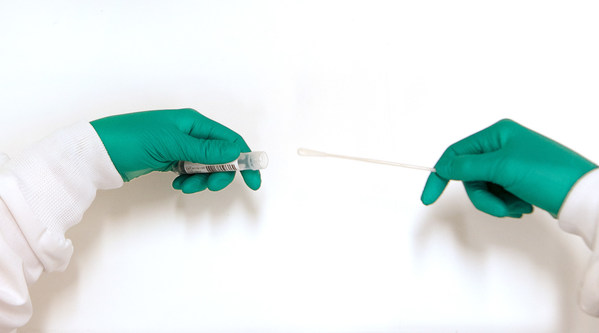
FDA 已批准 Zymo Research 的 DNA/RNA Shield™ 收集管成為第二類醫療裝置。FDA 的 510(k) 核准讓該產品可用作 2019 冠狀病毒病測試的體外診斷 (IVD) 裝置。
DNA/RNA Shield™ 收集裝置特別獲授權進行 2019 冠狀病毒病測試,是 FDA 批准的首項技術,可滅活病毒並保留 SARS-CoV-2 RNA。 SARS-CoV-2 病毒將被有效滅活,因此可以安全處理、運送及儲存樣本。這可保障一線醫護人員和化驗室員工的安全。病毒的 RNA 可在長時間內於室溫下保持穩定,並透過下游式 RT-PCR 進行強效分析。
Zymo Research 業務發展副總裁 Marc Van Eden 博士說:「在疫情爆發初期,DNA/RNA Shield 在各種傳染病應用中均表現出良好記錄,有助促進其在冠狀病毒病爆發下的快速採用和部署 。510(k) 是 FDA 與 Zymo Research 積極合作的成果,可將這項技術帶到目前測試和未來監控工作的最前線。」
該產品包括一個盛載 Zymo Research 專有 DNA/RNA Shield™ 運輸介質的收集管。運輸介質可確保 SARS-CoV-2 RNA 在樣本以室溫下運輸時的穩定性保持長達 28 天。DNA/RNA Shield™ 運輸介質可以配上消毒棉、痰液收集器,或直接使用收集管,以組成試劑盒。
該技術與懷疑含有 SARS-CoV-2 的上呼吸道和下呼吸道人類樣本相容。在 DNA/RNA Shield™ 收集管中收集和儲存的樣本非常適合與適當的分子診斷測試一併使用。
如欲了解更多資訊及價格,請瀏覽 Zymo Research 的網站或向他們傳送電郵:covid19requests@zymoresearch.com。
關於 Zymo Research Corp.
Zymo Research 是一家私人公司,自 1994 年以來一直使用最先進的分子生物學工具為科學及診斷界提供服務。「科學的美麗是簡化事物」是他們的座右銘,這點在公司產品的所有方面都表露無遺,包括表觀遺傳學及 DNA/RNA 純化技術等。Zymo Research 歷來被公認為表觀遺傳學的領導者,透過優質易用的樣本採集、微生物測量、診斷儀器和 NGS 技術的嶄新解決方案突破界限。關注 Zymo Research:Facebook、LinkedIn、Twitter 及 Instagram。
如欲了解更多 Zymo Research 的冠狀病毒病產品資訊,請瀏覽下列連結:
- Zymo Research 發佈免費軟件以簡化冠狀病毒病測試報告
- Zymo Research 的快速 SARS-CoV-2 多用途試劑盒獲得 CE IVD 標誌
- Zymo Research 的快速 SARS-CoV-2 rRT-PCR 試劑盒獲得 FDA 的緊急使用授權
- Zymo Research 的 Quick-DNA/RNA™ 的病毒 MagBead 試劑盒獲得 CE IVD 標誌
- Zymo Research 推出冠狀病毒病測序服務,用於新 SARS-CoV-2 變體的檢測和監視
- Zymo Research 透過 Environ™ 冠狀病毒病廢水測試服務提供社區範圍的 SARS-CoV-2 檢測和變種情況追蹤
圖片 - https://mma.prnasia.com/media2/1454300/510k_shield_fda_certified_pr_2000x1111px_v2.jpg?p=medium600
標誌 - https://mma.prnasia.com/media2/364743/Zymo_Research_Corp_Logo.jpg?p=medium600
精選視頻

- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt








