|
上海和香港2021年5月6日 /美通社/ -- 致力於研發和商業化創新腫瘤療法的領先生物製藥公司 -- 德琪醫藥有限公司(簡稱「德琪醫藥」,香港聯交所股票代碼:6996.HK)今日宣佈,中國腫瘤學權威機構中國臨床腫瘤學會(CSCO)發佈2021年診療指南,塞利尼索片(selinexor)有多項治療骨髓瘤和淋巴瘤的方案獲指南推薦。其中,指南新增塞利尼索片用於骨髓瘤的三項治療方案,包括:(i)塞利尼索片+地塞米松;(ii)塞利尼索片+地塞米松+硼替佐米;(iii)塞利尼索片+地塞米松+泊馬度胺,用於治療復發骨髓瘤。此外,指南還推薦使用塞利尼索片治療復發難治性瀰漫性大B細胞淋巴瘤(rrDLBCL)。CSCO指南作為中國臨床醫生指導腫瘤臨床診斷和治療的金標準,是國內最具有學術影響力的診療指南之一。
多發性骨髓瘤是一種克隆漿細胞異常增殖的惡性疾病,在很多國家是血液系統第二常見的惡性腫瘤。多發性骨髓瘤難以治癒且易復發,而且復發後缺乏標準的治療方案。隨著越來越多的新藥應用於臨床,如何選擇合適的治療方案也是臨床上面臨的難題。瀰漫性大B細胞淋巴瘤是一種高侵襲性的惡性腫瘤,近半數患者經一線治療後無法治癒,60%的rrDLBCL患者治療選擇有限。
塞利尼索片作為全球首個針對腫瘤治療全新機制的口服選擇性核輸出抑制劑(SINE),與核輸出蛋白XPO1緊密結合,抑制癌蛋白及其他GR通路,致癌蛋白失活,從而達到抗腫瘤作用。
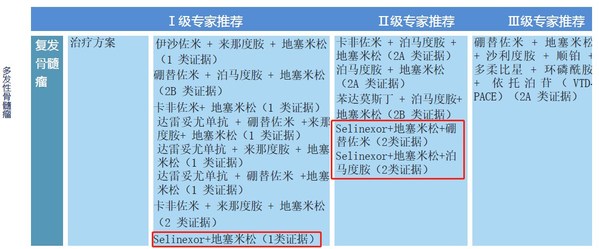
骨髓瘤
復發骨髓瘤
塞利尼索片+地塞米松治療方案獲I級專家推薦(1類證據)
塞利尼索片+地塞米松+硼替佐米治療方案獲II級專家推薦(2類證據)
塞利尼索片+地塞米松+泊馬度胺治療方案獲II級專家推薦(2類證據)
STORM試驗為多中心、單臂、開放標籤試驗,旨在探索塞利尼索片+地塞米松(Xd)在多線復發難治性多發性骨髓瘤(rrMM)中的療效,結果顯示對前期已接受中位7線治療的rrMM患者,Xd方案可以取得26%的客觀緩解率(ORR)。
STOMP試驗為多中心開放標籤隨機的I/II期試驗,探索不同Xd聯合方案在rrMM中的療效和安全性,試驗結果顯示:塞利尼索片+泊馬度胺+地塞米松組所有患者的中位無進展生存期(PFS)達12.2個月,對於II期推薦劑量(RP2D)組的患者,ORR達60%;對於蛋白酶體抑制劑(PI)非難治的患者,塞利尼索片+硼替佐米+地塞米松的ORR達84%。
淋巴瘤
淋巴瘤診療指南中也對塞利尼索片做了相應推薦。註釋中提到:rrDLBCL患者推薦選擇其他與CHOP(環磷酰胺、阿黴素、長春新鹼和潑尼松龍)無交叉耐藥的藥物即二線方案化療或個體化方案。西達本胺、伊布替尼、澤布替尼、奧布替尼、維布妥昔單抗、PD-1單抗、XPO抑制劑(selinexor)、BCL-2抑制劑等新藥單用或聯合治療也體現出初步療效。
SADAL試驗為塞利尼索片治療rrDLBCL的註冊試驗,試驗結果顯示所有患者ORR達28.3%,完全緩解率(CR)達12%,生發中心B細胞(GCB)樣型患者ORR達34%。
中華醫學會血液學分會主任委員、蘇州大學附屬第一醫院血液科主任吳德沛教授表示:「瀰漫性大B細胞淋巴瘤是一種異質性很強的血液腫瘤,涵蓋一組大細胞、轉化B細胞為表型的異質性、侵襲性淋巴瘤,導致正常淋巴結結構的瀰散性破壞。XPO1在DLBCL患者中高表達,且預示著不良預後。塞利尼索是全球首個口服選擇性XPO1抑制劑,已被NCCN指南推薦用於至少接受過2線治療(包括移植和CAR-T治療後疾病進展)的瀰漫性大B細胞淋巴瘤患者。2021年版CSCO淋巴瘤指南將塞利尼索納入推薦,為淋巴瘤提供新的治療選擇,相信塞利尼索可以惠及更多患者。」
中國醫藥教育協會血液學專業委員會主任委員、首都醫科大學附屬北京朝陽醫院血液科主任陳文明教授表示:「多發性骨髓瘤是一種常見的血液系統惡性疾病,隨著新藥的研發與應用,患者生存期逐漸延長,但患者無法治癒,患者終將耐藥復發。全新作用機製藥物塞利尼索可以克服多發性骨髓瘤的多藥耐藥,聯合化療可以使各種疾病狀態的骨髓瘤患者獲得快速、深度地緩解。塞利尼索納入本次CSCO指南推薦,為臨床帶來了更多選擇,期待它為更多患者帶來福音。」
關於塞利尼索(XPOVIO®)
塞利尼索是同類首款且唯一一款口服型選擇性核輸出抑制劑(SINE),由Karyopharm Therapeutics Inc.(納斯達克股票代碼:KPTI)研發,德琪醫藥進行研究。德琪醫藥在包括大中華區、南韓、澳大利亞、新西蘭和東盟國家的多個亞太市場獲得了塞利尼索的獨家開發和商業化權利。
2019年7月,美國FDA批准塞利尼索聯合低劑量地塞米松用於治療難治復發性多發性骨髓瘤患者。2020年6月,美國 FDA再次批准塞利尼索作為單藥治療難治復發性瀰漫性大B細胞淋巴瘤患者。2020年12月,美國FDA批准了塞利尼索聯合硼替佐米和地塞米松治療既往接受過至少一種治療方案的多發性骨髓瘤患者。2021年2月,以色列衛生部批准塞利尼索治療難治復發性多發性骨髓瘤和難治復發性瀰漫性大B細胞淋巴瘤。2021年3月,歐洲聯盟委員會(EC)批准塞利尼索治療難治復發性多發性骨髓瘤。
塞利尼索是目前首款且唯一一款被美國FDA批准的口服SINE化合物,也是首款可用於治療多發性骨髓瘤和瀰漫性大B細胞淋巴瘤的藥物。此外,塞利尼索針對多個實體腫瘤適應症開展了多項中期和後期臨床試驗,包括脂肪肉瘤和子宮內膜癌。2020年11月,德琪醫藥合作夥伴Karyopharm在2020 年結締組織腫瘤學年會(CTOS 2020)上報告了III期SEAL試驗的積極數據。SEAL是一項隨機、雙盲、安慰劑對照交叉試驗,旨在比較口服單藥塞利尼索與安慰劑在脂肪肉瘤患者中的療效。另外,Karyopharm公佈了塞利尼索用於治療子宮內膜癌患者的正在進行的III期SIENDO試驗已完成計劃的中期無效性分析,數據安全監查委員會(DSMB)推薦該試驗無需作任何修改按計劃繼續進行。SIENDO試驗的首要數據結果預計在2021年下半年公佈。
德琪醫藥正在中國開展塞利尼索治療多發性骨髓瘤、瀰漫性大B細胞瘤、外周T細胞和NK/T細胞淋巴瘤、子宮內膜癌和非小細胞肺癌等多項臨床試驗,5項試驗處於臨床後期。此外,德琪醫藥已在中國大陸、澳大利亞、韓國、新加坡等多個亞太市場遞交了新藥上市申請(NDA),並獲得國家藥品監督管理局(NMPA)授予的優先審評資格以及韓國食品醫藥品安全部(MFDS)授予的孤兒藥資格。
關於德琪醫藥
德琪醫藥有限公司(簡稱「德琪醫藥」,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物製藥領先企業,致力於為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥已在多個亞太市場獲得13個臨床批件(IND),並遞交了5個新藥上市申請(NDA)。德琪醫藥將以「醫者無疆,創新永續」為願景,專注於同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,於作出前瞻性陳述當日之後,無論是否出現新資料、未來事件或其他情況,我們並無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,並理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃於本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
*XPOVIO®為KaryopharmTherapeutics Inc.註冊商標。
相關股票: HongKong:6996
- 简体中文 |
- English |
- 日本語 |
- 한국어 |
- Bahasa Indonesia |
- Tiếng Việt